
搜索网站、位置和人员

新闻活动 beat365亚洲版官网
近日,beat365王怀民课题组在《美国化学会志》发表了题为“A Programmable Peptidic Hydrogel Adjuvant for Personalized Immunotherapy in Resected Stage Tumors”的研究论文。
研究团队利用多肽自组装技术,构建结构明确、功能分子可控的GrB响应水凝胶佐剂体系,通过原位注射到肿瘤切除后的手术腔内,实现个性化辅助免疫治疗。该GrB响应性设计思路,为高效安全佐剂的制备提供了一种精准化和智能化策略。
beat365特聘研究员王怀民为论文通讯作者,西湖大学2020级博士研究生吴碧寒为论文的第一作者。

辅助治疗如化疗、免疫疗法和靶向治疗等有助于降低肿瘤术后复发风险,提高患者的生存获益。尽管目前的免疫疗法,如免疫检查点阻断剂(ICB)等,在肿瘤治疗方面取得了重要进展,但仅有少数患者从中获益,部分原因是由于免疫抑制肿瘤微环境的存在。此外,免疫疗法通常采用全身给药方式,可能导致脱靶效应和免疫相关不良反应的产生。目前的研究重点在于提高靶向性,减少免疫相关不良反应,这些方法对提高免疫治疗的效果有着重大的应用潜力。然而,如何精确控制免疫治疗的疗效和安全性仍是科研人员面临的巨大挑战。
T细胞在免疫治疗中起着关键作用。在免疫治疗过程中,细胞毒性T细胞的效应功能依赖于颗粒酶B(GrB)的分泌。尽管GrB在免疫治疗中具有重要意义,但由于免疫抑制微环境的存在,其分泌和活性可因治疗手段和疾病类型的不同而存在差异。这种差异会显著影响免疫治疗的疗效。因此,利用T细胞杀伤肿瘤细胞过程中释放的GrB作为调控分子,开发GrB响应性体系,是一种高效安全的治疗策略。这种GrB响应策略可以实现免疫调节组分的原位激活,增加GrB的分泌量,从而提高免疫治疗的效果。同时将免疫调节作用限制在局部,减少免疫相关不良反应的发生。
王怀民研究团队利用多肽自组装技术,构建结构明确、功能分子可控的GrB响应水凝胶佐剂体系,通过原位注射到肿瘤切除后的手术腔内,实现个性化辅助免疫治疗。选取免疫佐剂咪唑喹啉类化合物IMDQ,通过GrB响应的多肽序列IEFD与自组装多肽序列共价偶联,并与含有共价交联的多肽分子混合形成水凝胶,同时搭载免疫原性死亡的肿瘤细胞,制备得到水凝胶佐剂。IMDQ的可控释放可以增强免疫细胞功能,增加GrB的分泌量,从而提高免疫治疗的效果。该水凝胶佐剂一方面可作为抗原的临时储库,持续释放并延长其体内暴露时间,招募免疫细胞,并将IMDQ的刺激和调节作用限制在局部,刺激长期免疫记忆的产生,在黑色素瘤和结直肠肿瘤小鼠模型上都展现出良好的预防作用。另一方面,该水凝胶佐剂可填充在肿瘤部分切除部位,利用T细胞杀伤肿瘤细胞过程中释放的GrB作为调控分子,释放IMDQ佐剂,刺激抗原递呈细胞活化,诱发抗原特异性免疫反应,增强ICB治疗效果,而不引起免疫相关不良反应。这种GrB响应性设计思路,为高效安全佐剂的制备提供了一种精准化和智能化策略。
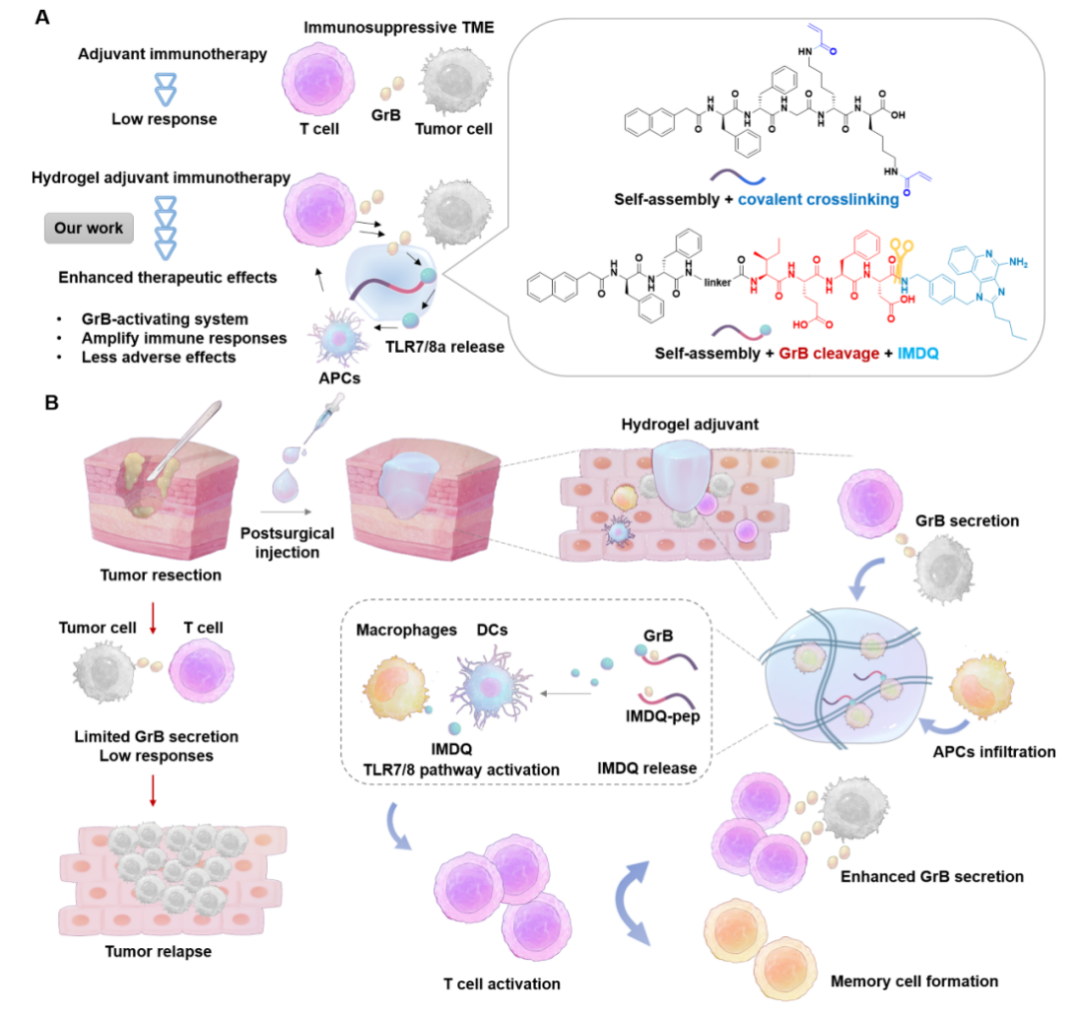
图1.多肽水凝胶佐剂的组成和抗肿瘤作用机制示意图
首先,研究合成了一种短肽分子NapffGk(aa)k(aa),由D构型自组装多肽序列Napff和丙烯酸修饰的赖氨酸残基组成,前者可提供氢键和芳香环间的非共价相互作用,后者可通过光交联反应生成共价键。IMDQ-pep多肽是以GrB响应的IEFD为连接基团,将IMDQ的氨基与含有自组装基团Napff和PEG链的多肽C端羧基键合而成。采用LC-MS、GPC和流变实验证实了NapffGk(aa)k(aa)多肽交联反应的发生和水凝胶的形成。将NapffGk(aa)k(aa)多肽和光引发剂混合,经光交联后制备得到水凝胶,同时搭载IMDQ-pep多肽和发生免疫原性死亡的肿瘤细胞,制备得到水凝胶佐剂IC+IP@Gel。SEM图像显示,纳米组装体在宏观尺度上形成多孔结构(蓝色),负载的肿瘤细胞(紫色)分散在水凝胶基质中,这种结构使得抗原能够在水凝胶中释放和扩散,进而刺激免疫细胞。流变结果表明,该水凝胶佐剂具有剪切稀化和快速恢复的特点,使其可以轻松地使用注射器进行注射。此外,该水凝胶佐剂能够以持续和可控的方式释放IMDQ和蛋白质抗原,释放过程可以用一级方程进行曲线拟合。
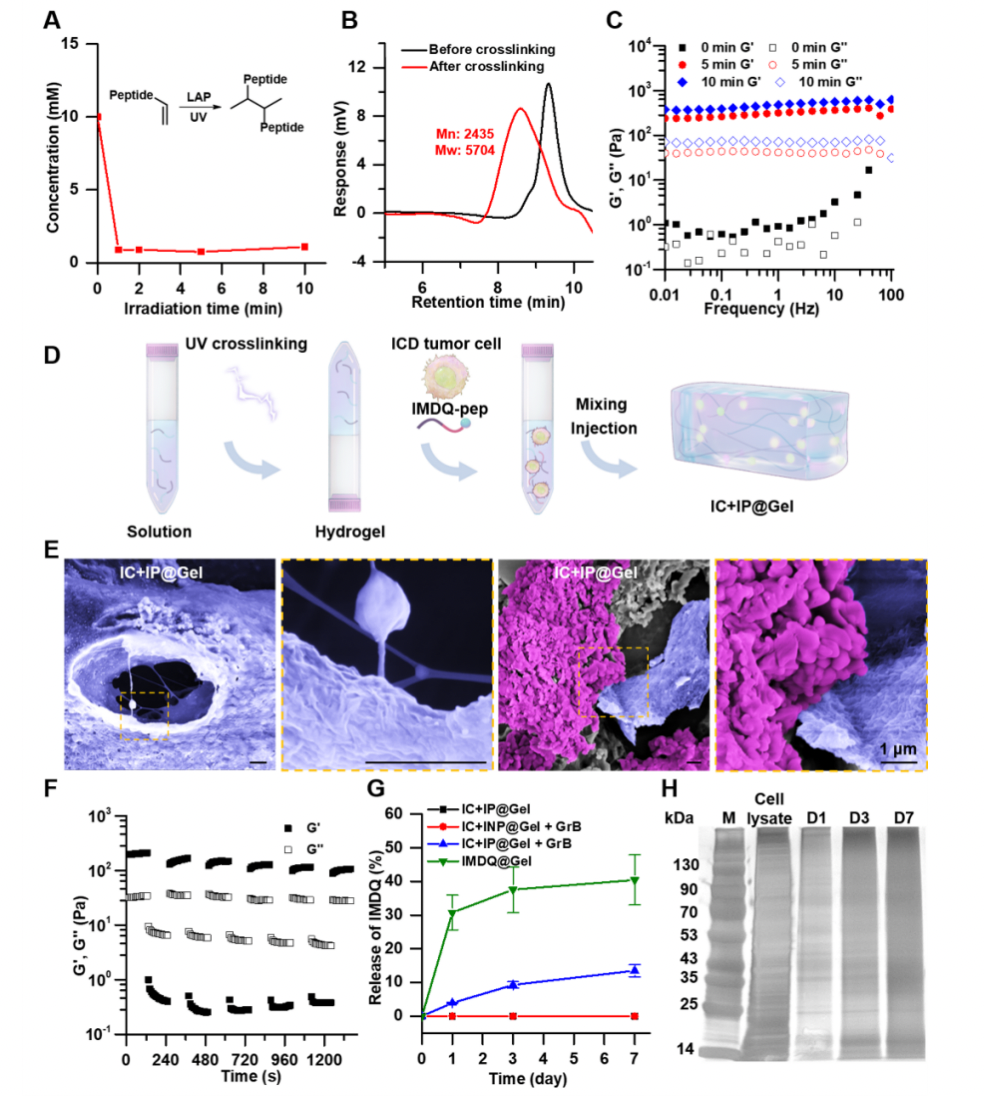
图2.共价交联多肽水凝胶和水凝胶佐剂的制备和表征
其次,该研究提取了小鼠骨髓来源的树突状细胞和骨髓来源的巨噬细胞研究多肽的体外免疫激活能力。流式分析结果表明,水凝胶佐剂成分可以刺激树突状细胞成熟,并将巨噬细胞重新极化为M1表型,同时刺激细胞释放促炎因子。体内免疫激活能力研究结果表明,水凝胶佐剂可以招募树突状细胞和巨噬细胞,具有刺激体内抗肿瘤免疫应答的能力。体内安全性实验结果表明,水凝胶佐剂不会引起全身性细胞因子分泌增加,且在大约21天后完全消失,表明了该水凝胶佐剂具有良好的生物降解性和生物安全性。
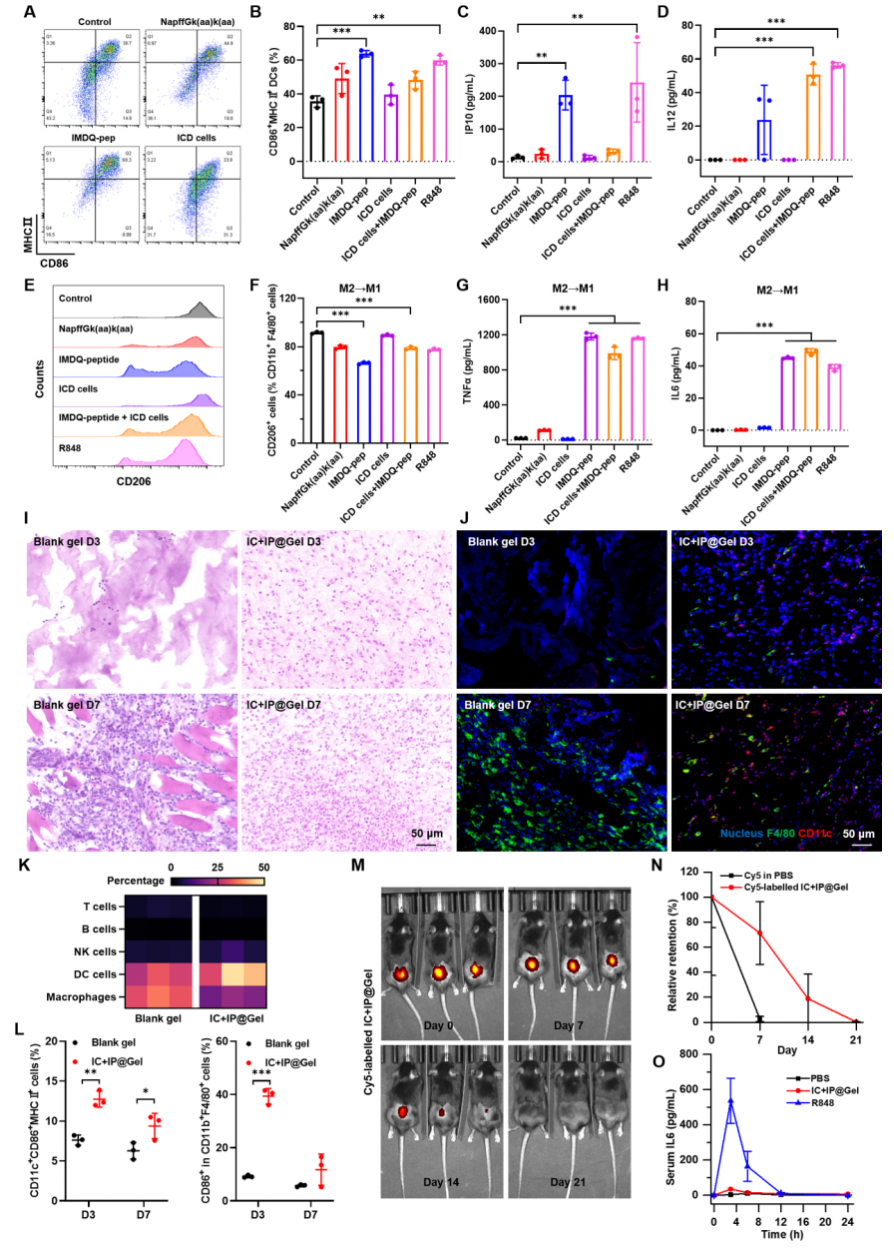
图3: 水凝胶佐剂的体外和体内免疫激活能力
进一步,该研究使用低免疫原性的B16F10肿瘤和高免疫原性的MC38肿瘤评价水凝胶佐剂的肿瘤预防作用。结果表明,与PBS组相比,注射水凝胶佐剂后的小鼠再次接种肿瘤细胞时肿瘤进展缓慢,肿瘤组织中T细胞浸润比例增加,免疫因子分泌量提高,脾脏中记忆效应T细胞比例上升,当再次遇到肿瘤抗原时,记忆T细胞可以被快速激活,产生强烈的免疫应答。表明注射水凝胶佐剂能够增强机体的抗肿瘤免疫反应,并有助于建立持久的保护性免疫效应。
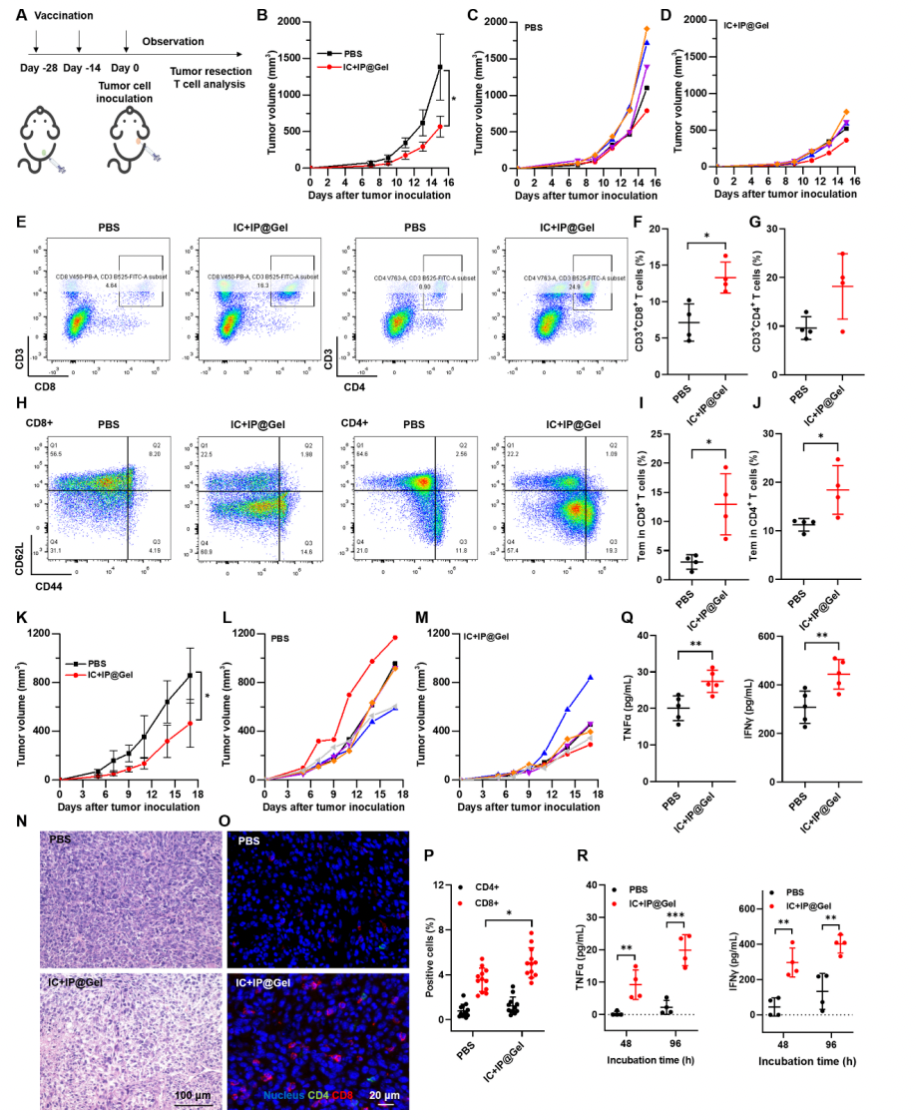
图4: 水凝胶佐剂的肿瘤预防作用
最后,该研究利用肿瘤术后复发模型评估水凝胶佐剂的协同抗肿瘤效应。结果表明,PBS组的小鼠均会出现肿瘤的快速复发,而水凝胶佐剂能够显著抑制肿瘤复发,并提高了小鼠存活率。流式和多因子检测结果表明,局部植入水凝胶佐剂可以改善免疫抑制肿瘤微环境,刺激肿瘤组织中细胞因子和趋化因子的分泌,并激活抗肿瘤T细胞反应。
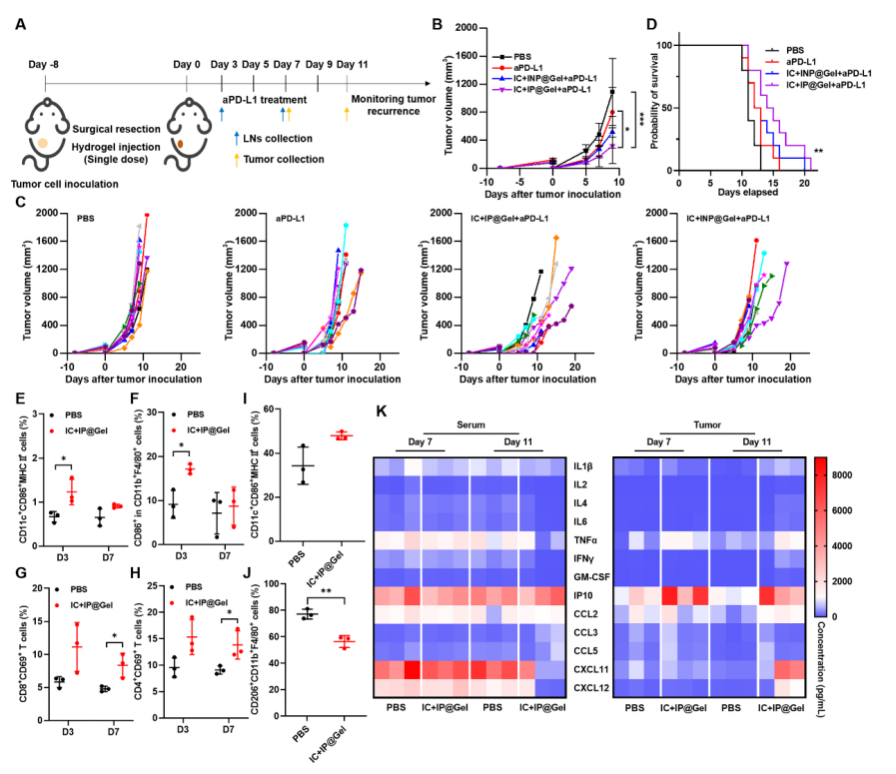
图5: 水凝胶佐剂的肿瘤治疗作用
这项研究利用T细胞杀伤肿瘤细胞过程中释放的GrB作为调控分子,在肿瘤局部实现IMDQ的精准释放,改善免疫抑制微环境,进一步增强GrB的分泌。这种双重作用能够激活抗肿瘤免疫效应,放大辅助免疫治疗的治疗效果,并产生抗肿瘤的长期免疫记忆效应,同时最大限度地减少免疫相关不良反应的发生。这种策略可以用于抗原及佐剂等功能成分的精准递送,为构建智能化免疫佐剂提供新平台。
该项成果得到了国家自然科学基金的资助,并获西湖大学物质科学和分子科学实验平台、生物医学实验技术中心和实验动物中心的支持。

















